辽宁省名校联盟2022-2023学年高一下学期6月联合考试化学
辽宁省名校联盟2022-2023学年高一下学期6月联合考试化学试卷答案,我们目前收集并整理关于辽宁省名校联盟2022-2023学年高一下学期6月联合考试化学得系列试题及其答案,更多试题答案请关注我们

辽宁省名校联盟2022-2023学年高一下学期6月联合考试化学试卷答案
以下是该试卷的部分内容或者是答案亦或者啥也没有,更多试题答案请关注微信公众号:趣找答案/直接访问www.qzda.com(趣找答案)


(5)结合信息,请确定I2与NaOH发生“歧化”反应的氧化产物:(写出必要的计算过程)。已知:①氧化还原反应可以拆分为两个半反应,标准电极电势分别表示为^(+)、^6(-),,标准电动势E^9=^6(+)-^9(-.如Zn+Cu^2+Zn^2++Cu的E^9=^6(Cu^2+/Cu)-^6(Zn^2+/Zn)。2E^0>0,该反应能自发进行,E^5>0.3V,反应趋于完全进行。0.该反应3^6(I2/I^-)=0.54V,^9(10^-/I2)=0.45V,'(1O3^-/I2)=0.21V①一般控制原料气中水油比[n(水):n(乙苯)]为9:1,,若水油比增大,乙苯的平衡转化率(填“增大”或“减小”),理由是②控制反应温度为600^C的理由是

(4)称取若干份质量均为0.6g的氧化铜,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图3①为确保氢气还原氧化铜所得固体产物不含Cu2O,,应采取的措施是反应结束后不断进入H至先置变收②小组同学对氢气还原氧化铜的反应过程提出如下假设:经历2CuO+H2Cu2O++H2O,H2+Cu2O2Cu+H2O两个反应,且在同一条件下两个反应同时进行。结合图3,通过计算分析该假设合理的依据是
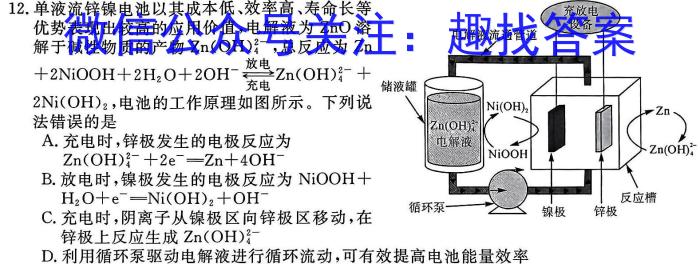
12.单液流锌镍电池以其成本低、效率高、寿命长等优势表现出较高的应用价值,电解液为ZnO溶解于碱性物质的产物Zn(OH)4^2-,总反应为Zn+2NiOOH+2H2O+2OH^-若Zn(OH)4^2-+2Ni(OH)2,电池的工作原理如图所示。下列说法错误的是A.充电时,锌极发生的电极反应为Zn(OH)4^2-+2e^-Zn+4OH^-B.放电时,镍极发生的电极反应为NiOOH+H2O+e^-Ni(OH)2+OH^-C.充电时,阴离子从镍极区向锌极区移动,在锌极上反应生成Zn(OH)4^2-D.利用循环泵驱动电解液进行循环流动,可有效提高电池能量效率